A Agência Nacional de Vigilância Sanitária (Anvisa) anunciou nesta quinta-feira (1º) que vai começar a análise do primeiro pedido de registro de uma vacina contra Covid-19 no Brasil.
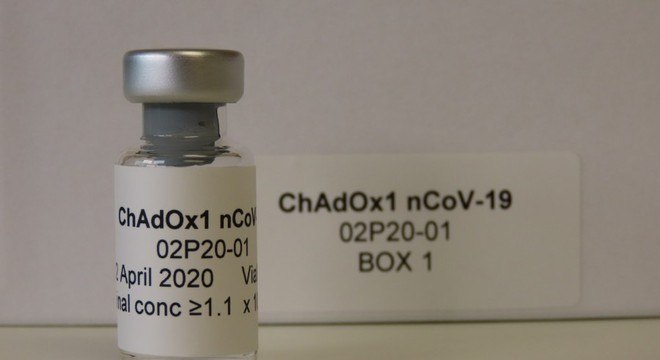
Na terça-feira (29), a agência reduziu a exigência da documentação inicial e simplificou o processo para análise dos imunizantes contra o novo coronavírus. Dois dias após o anúncio, o primeiro pedido foi protocolado pela AstraZeneca.
A farmacêutica britânica está desenvolvendo uma vacina em parceria com a Universidade de Oxford, que deverá ser produzida no Brasil pela Fundação Oswaldo Cruz (Fiocruz).
O pedido de análise junto à Anvisa é o passo inicial para que seja autorizada a aplicação da vacina no país. Entretanto, ainda é preciso que sejam concluídos os testes clínicos, que estão em andamento.
No atual estágio, os técnicos da Anvisa já podem avaliar os primeiros resultados dos testes, ainda dos estudos pré-clínicos, que não envolveram seres humanos. A ideia é agilizar o registro da vacina caso, futuramente, ela apresente resultados positivos de segurança e eficácia nas demais fases dos estudos. Esse protocolo é chamado de “revisão contínua” pela Anvisa.
Como funciona a ‘revisão contínua’:
Normalmente, para o registro de um medicamento ou vacina, as agências exigem todos os estudos e informações sobre a segurança, eficácia, e conteúdo de uma vez só.
Como o planeta passa por uma pandemia, a aplicação da ‘revisão contínua’ permite que os técnicos da Anvisa, ou outra agência reguladora, já comecem a analisar o que está pronto – resultados de estudos iniciais e outros dados, por exemplo.
As pesquisas são enviadas ao longo do tempo às agências, até o fim dos testes da fase 3, última etapa para garantir a eficiência de uma vacina em toda uma população. Todos os estudos deverão ser analisados, com a diferença de que o processo começa antes e em etapas.
Assim como a Anvisa, a Agência Europeia do Medicamentos (EMA) anunciou o início a revisão do primeiro grupo de dados disponibilizados pela AstraZeneca e pela Universidade de Oxford, também para tentar agilizar o futuro registro do produto. A reguladora europeia usará o mesmo procedimento adotado pelo Brasil.
Fonte: G1 GLOBO
Créditos: Polêmica Paraíba